Попередня сторінка: Багатоатомні спирти. Гліцерол
Наступна сторінка: Альдегіди
Пригадайте:
• теорію будови органічних сполук (за § 2);
• хімічні властивості бензену (за § 11) та спиртів (за § 14);
• що таке поліфункціональні сполуки (за § 3).
Поняття про феноли
Феноли — це клас ароматичних сполук, у яких група -OH сполучена безпосередньо з бензеновим ядром.
Найпростішою сполукою цього класу, в якій з бензеновим ядром сполучена тільки одна група -OH, є фенол:
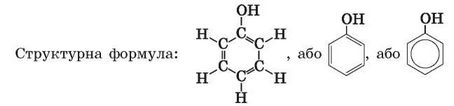

Молекулярна формула фенолу C6H5OH. Традиційна назва — карболова кислота.
Фенол відкрили у складі кам’яновугільної смоли. Першим хімічну будову фенолу та метод його синтезу із саліцилової кислоти запропонував французький хімік Ш. Жерар.

Феноли в природі
Сам фенол дуже отруйний, він є ксенобіотиком і в живій природі не трапляється. Але в природі існує багато речовин складнішої будови, в яких подібно до фенолу гідроксильна група сполучена з бензеновим ядром. Наприклад, рослинні поліфеноли — флавоноли, антоціани тощо. Це неотруйні речовини, вони є важливими рослинними метаболітами, зумовлюють різноманітне забарвлення рослинних тканин. Кераціанін — різновид антоціанів — зумовлює забарвлення вишні. Антоціани також надають червоного або синьо-фіолетового кольору пелюсткам квітів та плодам, зокрема чорниці, журавлини, малини, ожини, чорної смородини, баклажанів, буряку, винограду тощо.
Кверцетин — дуже поширений у природі представник флавонолів. Дуже багато його міститься в чаї, червоній цибулі, часнику, томатах, горобині, обліписі тощо. Поліфеноли у значній кількості потрапляють до нашого організму з рослинною їжею і виконують дуже важливу роль потужних антиоксидантів разом з вітамінами C та Е. Вони є незамінними компонентами їжі людини і допомагають нашому організму протидіяти виникненню злоякісних пухлин.

Фенол уперше був виділений з кам'яновугільної смоли 1834 року Ф. Рунге, а в чистому вигляді добутий зі світильного газу О. Лораном, який назвав його фенкислотою (від грец. faino — освітлювати). Після з'ясування складу речовини Ш. Жерар назвав його фенолом, щоб підкреслити його подібність до спиртів.
Фізичні властивості фенолу
• Свіжодобутий фенол — безбарвна кристалічна речовина;
• під час зберігання набуває рожевого забарвлення внаслідок часткового окиснення;
• *пл. = 42 °C; tRHm = 181,8 °C, але за нагрівання близько 90 °C займається;
• леткий, має специфічний стійкий запах (запах гуаші, або так званий «карболовий запах»);
• обмежено розчинний у холодній воді (6,5 г на 100 мл), але необмежено розчиняється в гарячій воді;
• отруйний! У разі потрапляння на шкіру спричиняє хімічні опіки.

Хімічні властивості фенолу Молекули фенолу містять бензенове ядро (як арени) та гідроксильну групу (як спирти), отже, він має виявляти властивості як аренів, так і спиртів.
1. Взаємодія з лужними металами. Феноли виявляють кислотні властивості і за звичайних умов взаємодіють з активними металами. Реакція відбувається так само, як і у спиртів: атоми металічних елементів заміщують атоми Гідрогену гідроксильної групи:

Фенол активно взаємодіє:
• з лужними металами (як і спирти);
• лугами (на відміну від спиртів);
• бромом (набагато активніше за бензен).
2. Взаємодія з лугами. Феноли виявляють сильніші кислотні властивості, ніж спирти, і на відміну від них взаємодіють з лугами:

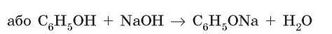
Здатність фенолу взаємодіяти з лугами зумовлена впливом бен-зенового ядра на зв’язок O-H у гідроксильній групі. Завдяки цьому впливу зв’язок O-H більш полярний, ніж у спиртах, і легше розривається. Унаслідок цього фенол хоч і незначною мірою, але дисоціює у водному розчині:
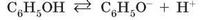
Але кислотні властивості фенолу настільки слабкі, що навіть така слабка кислота, як карбонатна, витісняє фенол із розчину його солей:
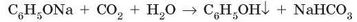
Виявлення фенолом кислотних властивостей надихнуло Ф. Рун-ге назвати фенол карболовою кислотою. Ця назва до наших часів збереглася у медицині.
3. Взаємодія з бромом. Фенол активно взаємодіє з бромом. Під час змішування розчину фенолу з бромною водою за звичайних умов утворюється нерозчинний білий осад 2,4,6-трибромофенолу:

Реакцію з бромом використовують для виявлення фенолу в розчині — це якісна реакція на фенол (мал. 17.1).
Ця хімічна властивість фенолу характеризує вплив гідроксильної групи на бензенове ядро. Пригадайте, бензен взаємодіє з бромом за досить жорстких умов. Якщо в молекулі бензену замістити атом Гідрогену на групу -OH, то реакційна здатність бензенового ядра суттєво зростає: у фенолу хімічна активність набагато вища за бензен. Хімічні реакції заміщення атомів Гідрогену в бензеновому ядрі фенолу відбуваються набагато активніше.
Зокрема, фенол бромується за звичайних умов навіть з розчином брому (бромною водою) із заміщенням одразу трьох атомів Гідрогену в бензеновому ядрі.

Реакція нітрування
Як і бензен, фенол піддається нітруванню дією нітратної кислоти. Але, на відміну від бензену, реакція відбувається навіть за звичайних умов або за незначного нагрівання із заміщенням трьох атомів Гідрогену в бензеновому ядрі:
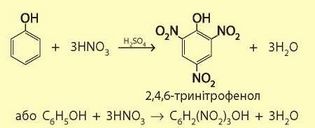
Продукт повного нітрування фенолу — 2,4,6-тринітрофенол — жовта кристалічна речовина, інша її назва — пікринова кислота. Цю кислоту спочатку використовували як жовтий барвник для вовни та шовку, а потім виявили її вибухові властивості й до Другої світової війни використовували для виготовлення боєприпасів. Сьогодні пікринову кислоту застосовують у криміналістичній практиці для виявлення деяких наркотичних речовин.
Застосування фенолу
Раніше фенол (карболова кислота) був одним з найважливіших антисептиків і широко використовувався для дезінфекції приміщень, меблів, хірургічних інструментів. Сьогодні фенол рідко застосовують як антисептик, його замінили іншими речовинами. Але значно збільшується роль фенолу в синтетичній промисловості. Світове виробництво фенолу сягає понад 8 млн тонн на рік, він посідає 17-те місце за обсягом органічних речовин, що виробляє світова хімічна промисловість.
Майже половина одержаного фенолу йде на виробництво полікарбонатів та епоксидних смол. Завдяки механічним та оптичним властивостям полікарбонатів їх використовують для виготовлення лінз, фар, компакт-дисків, а також прозорих матеріалів для крівлі й фасадів будівель, шумових загороджень доріг тощо.
Значні обсяги фенолу витрачають на виробництво фе-нолоформальдегідних смол. Ці смоли є в’яжучим компонентом деревоволокнистих та деревостружкових плит (ДВП та ДСП). Із пластмас на основі цих смол виготовляють східці для ескалаторів метро, електролічильники, вимикачі, корпуси телефонів та інших апаратів, а також шахи, шашки, доміно тощо.
Фенол є сировиною для виробництва синтетичних волокон — нейлону та капрону.
Також фенол необхідний у виробництві деяких поверхнево-активних речовин (ПАР).
У фармацевтичній промисловості фенол використовують для синтезу різноманітних лікарських препаратів, зокрема аспірину. Розбавлені розчини фенолу (1-4 %) використовують як антисептичні та знеболювальні засоби в лікуванні деяких захворювань та у стоматології («Орасепт», «Фукорцин»).
Природоохоронні аспекти застосування фенолу
Фенол дуже отруйний, він належить до високонебезпечних речовин (2-й клас небезпеки), гранично допустима концентрація (ГДК) фенолу у воді становить 1 • 10-6 г/л, а смертельна доза для людини — 1 г. У разі вдихання фенол спричиняє порушення роботи нервової системи, подразнення слизових оболонок, хімічні опіки шкіри. Просочуючись крізь навіть неушкоджену шкіру, фенол уже через кілька хвилин діє на тканини головного мозку і згодом спричиняє параліч дихального центру.
Оскільки фенол використовують на багатьох різних підприємствах, то він може міститися в промислових виливах. Тому дуже важливою є проблема охорони природних вод від потрапляння фе-ноловмісних речовин. Для цього необхідно ретельно контролювати та очищувати всі промислові води від фенолу.
Хоча фенол отруйний сам по собі, але потрапляння його у водойми є причиною ще більшої небезпеки. Перед потраплянням у водопровідну мережу воду з відкритих водоймищ знезаражують хлором. Якщо до водойми потрапив фенол, то із хлором він утворює набагато токсичніші речовини — хлорофеноли та діоксини, токсичність яких у 100-300 разів перевищує токсичність самого фенолу:

2,3,7,8-тетрахлородибензо-шра-діоксин — найтоксичніший представник діоксинів
Одна з найбільших трагедій, пов’язаних з викидами фенолу, сталася навесні 1990 року в м. Уфа (Башкортостан). У результаті
техногенної катастрофи на території підприємства ВО «Уфахімп-ром» відбувся витік десятків тонн фенолу в річку Шугуровка, звідки отруєна вода потрапила у водопровідну мережу Уфи. Концентрація фенолу майже у 100 разів перевищувала ГДК, із кранів текла вода з характерним карболовим запахом. Від нормального водопостачання було відрізано майже 700 тис. людей.

б грудня 1917 року в гавані канадського міста Галі-факс зіткнулися два військові кораблі «Монблан» та «їмо». Судно «Монблан» було навантажене пікриновою кислотою (тринітрофенолом), піроксиліном, тротилом та бензеном. У результаті зіткнення на «Монблані» почалася пожежа, що спричинила вибух. Вибух був настільки потужним, що порт та значна частина міста були знищені, майже 2000 осіб загинуло в момент вибуху, 9000 було поранено, а 400 втратили зір. Стокілограмовий фрагмент судна «Монблан» було згодом знайдено на відстані 20 км від місця катастрофи. Вибух у Галіфаксі був найпотужнішим вибухом доядерної епохи. Про ці події 2003 року знято фільм «Зруйноване місто» (реж. Б. Піттман).
Ключова ідея
Хімічні властивості фенолу є ілюстрацією справедливості другого постулату теорії будови органічних сполук про взаємний вплив атомів у молекулі.
Лінгвістична задача
Порівняйте латинські назви елемента «Карбон» та речовини «карболова кислота». Як ви вважаєте, про що свідчить інша назва фенолу?
Контрольні запитання
253. Наведіть молекулярну та розгорнуту структурну формули фенолу.
254. Схарактеризуйте фізичні властивості фенолу. Чим вони відрізняються від властивостей спиртів? Чим це зумовлено?
255. Схарактеризуйте хімічні властивості фенолу.
256. У чому виявляються кислотні властивості фенолу? Порівняйте кислотні властивості фенолу та спиртів.
257. Схарактеризуйте взаємний вплив бензенового ядра та гідроксильної групи у фенолі. Як цей вплив позначається на хімічних властивостях фенолу?
258. Опишіть якісні реакції на фенол.
259. Схарактеризуйте небезпечність потрапляння фенолу в навколишнє середовище.
Завдання для засвоєння матеріалу
260. Серед наведених структурних формул визначте формули сполук, що належать до фенолів.

261. Із переліку речовин — CH3OH, CH4, C3H5(OH)3, C6H5OH — виберіть ті, що взаємодіють: а) з Na; б) NaOH; в) Br2; г) розчином Br2.
262. Складіть рівняння реакції, що ілюструють відмінності у хімічних властивостях фенолу та: а) етанолу; б) бензену. Відповідь поясніть.
Комплексні завдання
263. До розчину фенолу додали бромну воду, утворився осад масою 49,65 г. Обчисліть масу фенолу, що вступив у реакцію.
264. Обчисліть масу розчину натрій гідроксиду з масовою часткою лугу 4 %, необхідного для нейтралізації розчину фенолу масою 200 г із масовою часткою 0,705 %.
265. Зразок фенолу масою 47 г змішали з розчином калій гідроксиду масою 953 г. У результаті утворився розчин з дуже лужним середовищем. Обчисліть масу солі в утвореному розчині.
266. Зразок технічного фенолу масою 1 г розчинили в надлишку розчину лугу. Крізь отриманий розчин пропустили вуглекислий газ до припинення виділення осаду. У результаті утворився осад масою 0,95 г. Обчисліть масову частку домішок у технічному фенолі.
267. Розчин фенолу в пропанолі масою 10 г із масовою часткою фенолу 1,41 % змішали з розчином калій гідроксиду. Крізь утворений розчин пропустили вуглекислий газ. Обчисліть максимальну масу осаду, що може утворитися під час пропускання газу.
Завдання з розвитку критичного мислення
268. Запропонуйте хімічний спосіб розділення суміші етанолу та фенолу.
269. У додаткових джерелах знайдіть інформацію про застосування фенолу та продуктів його переробки.
Міні-проекти
270. Фенол та подібні до нього сполуки, зокрема природні поліфеноли, можна виявити в розчині за допомогою ферум(ііі) хлориду. Ця реакція є якісною для виявлення сполук, у молекулах яких є гідроксильні групи, сполучені з бензеновим ядром (так званий «фенольний гідроксил»). Для реакції застосовують дуже розбавлений розчин ферум(ііі) хлориду світло-жовтого кольору. Під час змішування його з розчином, що містить «фенольний гідроксил», частіше розчин набуває темно-синього забарвлення. Перевірте на вміст поліфенолів харчові продукти рослинного та тваринного походження. У додаткових джерелах інформації знайдіть, які саме сполуки з «фенольним гідроксилом» можуть міститися у цих продуктах.
Це матеріал з підручника Хімія 10 клас Григорович
Наступна сторінка: Альдегіди